通过EMS诱变日本晴获得1个极端矮化突变体
We have isolated a dwarf mutant
20世纪60年代, 全世界范围内兴起了水稻生产的“绿色革命”, 以水稻半矮秆基因 SD1在水稻矮化育种领域的应用为标志, 大大提高了水稻产量。鉴于半矮秆基因 SD1在 “绿色革命”中所起到的重要作用, 对水稻矮生性状的遗传研究逐渐受到科研工作者重视[1,2,3,4,5,6,7,8]。 SD1编码GA20氧化酶(GA20 ox2), 在赤霉素合成中起关键作用, 催化GA53→GA44→ GA19→GA20三个反应[9]。 D18编码的GA 3β羟化酶[10,11]也是赤霉素合成过程中的关键酶。在已报道的突变体 s2-9和 s1-146a中, GA 3β羟化酶完全失去催化活性, 不能合成具有生物活性的赤霉素, 突变体植株表现严重矮化[11]。这种因为不能合成具有生物活性的赤霉素而发生的突变, 称为赤霉素缺陷型。Ueguchi-Tanaka等[12]在水稻中鉴定出第1个赤霉素受体GID1。GID1作为一种可溶性受体介导赤霉素信号传导, 在与活性的赤霉素结合、感知赤霉素信号后, 将信号传递到DELLA蛋白, 从而诱发一系列下游反应[12,13]。突变体 gid1呈现赤霉素不敏感的极端矮化表型, 而 GID1过量表达则会导致赤霉素超敏感的表型[14]。这种因为赤霉素的信号传导途径受破坏而发生的突变, 称为赤霉素钝感型。上述可见, 水稻的矮生性状与赤霉素有着密切的关系。新的水稻矮生性基因的发掘、研究与应用对于水稻高产遗传育种及植物激素的分子生物学机制研究具有重要意义。
赤霉素是一类广泛存在于植物等生物中的二萜类化合物, 作为一种重要的植物激素, 能调控植物的多种生长发育过程, 如植物种子的萌发、茎的伸长、叶片的生长、休眠芽的萌发以及植物的花和种子的发育等[15]。牻牛儿基牻牛儿基焦磷酸(geranylgeranyl diphosphate, GGDP)是一种含20个碳原的双萜类化合物,是赤霉素生物合成的前体[16], 经过两步环化合成内根-贝壳杉烯(ent-kaurene)。第一步反应是柯巴基焦磷酸合酶(ent-copalyl diphosphate synthase, CPS)催化GGDP转变为二环中间产物内根-柯巴基焦磷酸(ent-copalyl diphosphate, CDP), CPS是正式进入赤霉素生物合成途径的第1个关键酶基因, CPS若完全突变, 植物不能产生赤霉素。第2步反应是CDP在内根-贝壳杉烯合酶(ent-kaurene synthase, KS)的作用下转变为内根-贝壳杉烯。这两步反应都是在质体内完成的, 被认为是在总体水平上调控赤霉素合成的关键位点[17]。
CPS作为赤霉素合成途径的第1个关键基因, 其突变严重影响植物的发育。目前在拟南芥中发现的9个 ga1突变体都是 CPS基因不同程度的功能缺失突变体, 表现为植株矮化, 雄性不育, 严重的等位突变体不能萌发[18,19]。玉米 an1突变体是 mu转座子插入 CPS基因内部造成的, 表现半矮化、节间缩短、叶子宽而短、雄穗分枝减少、在雌穗上生长花药等[20]。在豌豆 ls-1突变体中, CPS基因转录本不能正常拼接, 导致植株矮化, 但花发育和花粉育性正常[21]。在水稻中, 采用生物信息学方法预测了4个 OsCPS基因, 并采用反向遗传学手段筛选到 OsCPS1 基因的2个突变体 oscps1-1和 oscps1-2, 表现严重矮化, 没有花和种子的发育[22], 但目前尚缺乏对水稻 CPS基因及其突变体的详细研究。
本文报道了1个水稻极端矮化突变体 s2-47, 对其进行了表型分析, 赤霉素敏感性检测, 以及基因定位克隆, 发现它是水稻 OsCPS1基因的1个新的等位突变体。对其进化关系和表达模式的分析及其蛋白结构域的预测, 加深了对 OsCPS1基因在赤霉素合成途径中重要功能的认识。
以化学诱变剂甲基磺酸乙酯(ethyl methylsulfonate, EMS)诱变粳稻品种日本晴, M1代按单株收种, M2代每个株系种植1行, 大约20株。在M2代发现1个株系分离出5株极端矮化突变体, 命名为 s2-47, 野生型与突变体符合3∶1的分离比例, 说明 s2-47为单基因隐性突变。该矮化突变体不能抽穗结实, 只能通过同1个株系中的表型正常的杂合个体繁殖和保存。使用杂合体与籼稻品种Dular杂交, F1单株自交获得F2群体, 分离产生的极端矮化个体作为基因定位群体。
1.2.1 GA处理水稻幼苗 参考王慧等[23]的方法, 野生型日本晴和 s2-47杂合体在出芽后于28℃光照培养箱内水培1周。分别对日本晴和分离出的极矮个体用10 mg L-1的外源赤霉素(GA3)溶液处理, 同时设未处理对照。处理3 d、5 d和7 d后观察表型并测量株高。
1.2.2 α-淀粉酶活性测定 采用Lanahan等[24]的碘熏蒸法测定水稻籽粒糊粉层的α-淀粉酶活性。制备固体淀粉培养平板, 基本成分为0.2%马铃薯淀粉(SIGMA, S4251-100)、2%琼脂、10 mmol L-1NaAc和2 mmol L-1CaCl2, pH 5.3, 另加50 μg mL-1氨苄青霉素用于抑制杂菌生长。用于诱导α-淀粉酶活性的平板中再加入1 μmol L-1GA3。将日本晴及 s2-47杂合体种子去壳后用30%的次氯酸钠表面灭菌30 min, 并横切种子成两半。种子有胚的一半萌发成苗, 根据表型是否极端矮化判断该粒种子是否为 s2-47纯合突变体。无胚的一半垂直放在淀粉平板上, 30℃黑暗条件下培养4 d。用碘(SCR, 10011517)蒸汽熏蒸培养皿, 使淀粉平板染色。能分泌淀粉酶的种子, 其周围淀粉被分解, 呈无色透明, 不能分泌淀粉酶的种子, 其周围呈蓝紫色。
| 表1 本研究所用的引物 Table 1 Primers used in this study |
1.2.3 赤霉素含量测定 取三叶期的野生型与突变体 s2-47地上部分各0.25 g, 加0.01 mol L-1 PBS缓冲液1 mL, 研磨成匀浆, 8000转 min-1离心10 min,收集上清液。按照植物赤霉素ELISA检测试剂盒(北京鑫方程生物技术有限公司)说明书测定总GA含量。所用抗体为anti-Gibberellins antibody (Biocompare, 货号ABIN707516), 野生型与突变体 s2-47各做5次重复。用赤霉素标准品的浓度与OD值计算出标准曲线的直线回归方程式, 将样品的OD值代入方程式, 计算出供试样品的赤霉素浓度, 再乘以稀释倍数, 即为样品的实际浓度。
1.2.4 基因初步定位 采用CTAB法提取水稻全基因组DNA[25]。所用的标记为本实验室根据籼、粳稻序列之间插入或缺失差异设计的170个InDel标记。采用集团分离分析法(BSA)[26]初步筛选可能连锁的标记, 再根据F2极矮个体的基因型判断是否连锁。使用的PCR扩增体系含10×PCR Reaction buffer 1 µL、引物(10 µmol L-1) 1 µL、模板DNA 1 µL、dNTP (2.5 mmol L-1) 0.1 µL、TIANGEN Taq DNA聚合酶(5 U µL-1) 0.1 µL, 补超纯水至10 µL。PCR扩增条件为94℃预变性5 min, 94℃变性30 s, 57℃退火30 s, 72℃延伸30 s, 循环数为35, 72℃延伸5 min。8% 聚丙烯酰胺凝胶电泳250 V 1 h, 硝酸银染色后照相分析。
1.2.5 基因精细定位 利用本实验室已测序的籼稻品种Dular全基因组序列(待发表)与NCBI (http://www.ncbi.nlm.nih.gov/)上提供的粳稻品种日本晴基因组序列比对, 选取在初步定位区间内插入或缺失10~30 bp的多态性区域, 设计扩增产物为200 bp左右的InDel标记引物(表1)。扩大基因定位群体, 进一步缩小定位区间。
1.2.6 候选基因分析 通过美国密西根州立大学水稻基因组注释网站(http://rice.plantbiology.msu. edu/), 查阅位于精细定位区间内的所有编码框(ORF), 并分析可能的候选基因。使用高保真DNA聚合酶PrimeSTAR (TaKaRa) PCR扩增候选基因 的基因组DNA片段, 将PCR产物直接测序, 测序 引物序列见表1。使用DNAStar软件比对分析测序结果。
1.2.7 RNA的提取及半定量检测 使用RNA提取试剂盒(北京博迈德科技发展有限公司)提取水稻不同组织的RNA, 反转录获得cDNA。以 Actin基因为内参, 调节模板cDNA的用量, 再扩增 OsCPS1基因, 引物序列见表1。PCR体系含10×Reaction buffer 1 µL, 引物(10 µmol L-1) 1 µL, 模板cDNA (日本晴, 1 µL; s2-47, 1 µL), dNTP (2.5 mmol L-1) 0.1 µL, TIANGEN Taq DNA聚合酶(5 U µL-1) 0.1 µL, 补超纯水至10 µL。PCR扩增条件为94℃预变性5 min, 94℃变性30 s, 57℃退火30 s, 72℃延伸30 s, 循环数为35, 72℃延伸5 min。
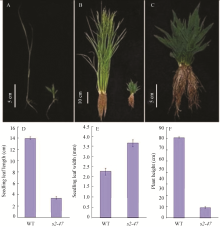
s2-47突变体在苗期就表现出非常明显的矮化, 叶片短宽并且颜色深绿(图1-A)。在三叶期, 突变体的第3片叶长2.5 cm左右, 为野生型的17.9% (图1-D), 而叶宽是野生型的1.6倍(图1-E)。在野生型日本晴生长到抽穗期时, s2-47表现出极端矮化(图1-B), 株高只有10 cm左右, 仅为野生型的12.5% (图1-F)。此外, s2-47突变体不能抽穗结实(图1-C), 只能通过杂合体繁殖和保存种子。
为了明确 s2-47的表型是否与赤霉素的合成或信号传导途径有关, 对幼苗进行GA处理。处理前, s2-47突变体与日本晴的株高差异明显(图2-A)。用10 mg L-1的外源赤霉素(GA3)处理7 d后, 不仅日本晴相对于未处理植株的株高明显增加(图2-B), s2-47突变体的株高也显著增加(图2-C), 株高约为对照组的3倍(图2-D)。虽然GA3处理后 s2-47的株高未达到日本晴的高度, 但其增长曲线与日本晴是平行的(图2-D)。该结果表明 s2-47突变体可以感受并正常传导GA信号, 推测其矮化表型可能与GA的合成途径缺陷有关。
为了进一步证明 s2-47突变体的突变基因参与
GA的生物合成而非信号传导途径, 做了GA3对水稻籽粒糊粉层α-淀粉酶的诱导实验。结果显示, 在GA3处理下, s2-47突变体的响应与野生型相同, 均能诱导α-淀粉酶的表达, 降解籽粒周围的淀粉, 从而在碘蒸汽熏蒸时不变蓝色(图3-A), 这说明 s2-47突变体对GA响应不受影响。
通过上述幼苗和籽粒糊粉层对GA敏感度实验推测 s2-47突变体的矮化表型应与GA的合成有关, 因此进一步测定了幼苗内源总GA含量。结果表明, s2-47突变体中总GA含量显著低于野生型( P≤0.01) (图3-B)。
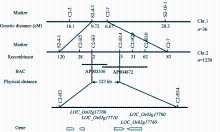
2.4.1 初步定位 为了定位 s2-47突变体的矮化突变基因, 首先采用集团分离分析法(BSA)对均匀分布于水稻12条染色体上的170个InDel标记初步筛选。在第2染色体上共筛选出4个可能与 s2-47矮化表型连锁的InDel标记, 即C2-3、S2-4-1、C2-7和S2-10-1 (表1)。然后用这4个标记检测36株F2代群体中的矮化突变单株, 得到这些标记与突变基因之间的遗传距离分别为18.1、9.72、6.67和28.3 cM, 突变基因被初步定位于S2-4-1和C2-7之间(图4)。
2.4.2 精细定位 为精细定位该极端矮化基因, 将定位群体扩大到1250株F2代矮化单株, 使用两侧的标记S2-4-1和C2-7分别检测到120个和83个重组事件。根据粳稻品种日本晴和籼稻品种Dular基因组序列之间的差异, 在S2-4-1至C2-7的区间内设计了5对InDel标记, 即C2-H5、C2-H3、C2-H14、C2-H29和C2-H10 (表1), 分别检测到28、2、3、31和62个重组事件。最终将导致 s2-47矮化的基因精细定位在C2-H3和C2-H14之间, 这2个标记分别在BAC克隆AP006160和AP004872上, 物理距离为123 kb (图4)。
使用Rice Genome Annotation Project (水稻基因组注释系统)网站(http://rice.plantbiology.msu.edu/)预测该定位区间内的基因, 共得到4个开放读码框(图4和表2)。其中 LOC_Os02g17780编码柯巴基焦磷酸合成酶(copalyl diphosphate synthase) OsCPS1, 是赤霉素生物合成途径的第1个关键酶。鉴于此, 将 LOC_Os02g17780( OsCPS1)确定为候选基因。
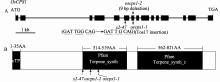
水稻 OsCPS1基因由15个外显子和14个内含子组成, 基因组DNA全长为9.671 kb, 编码区长度为2.604 kb, 编码的柯巴基焦磷酸合成酶由867个氨基酸组成(图5)。将 s2-47突变体中的 OsCPS1基因组DNA进行PCR扩增和测序, 分成S1至S9共9个片段(表1)。测序结果显示 s2-47突变体中的 OsCPS1基因, 从ATG开始计数第5922位的碱基G缺失, 该碱基缺失发生在第6个外显子上(图5-A), 位于编码区的第941位, 导致从第313个氨基酸后发生移码突变, 并出现提前终止密码子, 使该突变基因编码的蛋白质缺失554个氨基酸。
OsCPS1蛋白N端1~35个氨基酸为叶绿体转 运肽(cTP) (图5-B), 说明CPS1定位于叶绿体中, 这与CPS在质体内发挥作用的报道是一致的[16]。 在第314至519氨基酸, 第562至821氨基酸之间有Terpene_synth和Terpene_synth_C两个保守的功能结构域,在 s2-47突变体中这2个功能结构域完全缺失(图5-B)。
| 表2 定位区间内基因功能注释 Table 2 Genes annotated in mapping region |
在水稻基因组中还有3个 OsCPS1的同源基因即 OsCPS2、 OsCPS3和 OsCPS4, 在氨基酸水平上与OsCPS1的同源性分别为50%、55%和54%。由于 s2-47突变体的营养生长和生殖生长都表现严重缺陷, 推测只有 OsCPS1参与赤霉素合成途径, 其余3个基因可能具有其他功能。已有文献报道 OsCPS2和 OsCPS4参与从牻牛儿基牻牛儿基焦磷酸(geranyl- geranyl diphosphate)合成植保素(phytoalexin)的途径[29]。
柯巴基焦磷酸合成酶基因 CPS在不同植物中普遍存在。使用MEGA4软件[27], 通过Neighbor- joining方法[28]获得了 CPS基因的进化树(图6)。水稻OsCPS1与玉米An1亲缘关系最近, 所在的进化分支中还包括OsCPS3和OsCPS4。拟南芥GA1、豌豆LS与其他几个双子叶植物的CPS基因聚在另一个进化分支上, 而水稻OsCPS2则单独在一个进化分支上。
采用半定量RT-PCR检测了 OsCPS1基因在水稻根、节间、节、叶片、叶鞘、幼穗、成熟穗等器官中的表达情况。 OsCPS1在根中的表达量极低, 但在地上部分各个器官都有表达, 尤其在节和幼穗中的表达量较高(图7-A)。这与赤霉素主要在植物生长旺盛的部位合成一致。
经过外源GA3(浓度为1×10-4mol L-1)处理的野生型中 OsCPS1的表达量降低(图7-B), 而在 s2-47突变体中 OsCPS1的表达却升高(图7-C)。说明 OsCPS1的表达受体内GA含量的反馈调节。
赤霉素对植物生长发育具有十分重要的调节作用。根据矮化植株对赤霉素响应的不同, 可将其划分为赤霉素缺陷型和赤霉素钝感型。本研究中, s2-47突变体幼苗的GA处理和α-淀粉酶的诱导实验均表明该突变体为赤霉素缺陷型, 即 s2-47自身不能合成有生物活性的GA或合成量极低, 但其信号传导途径正常, 在添加外源活性GA3的情况下, 株高显著增加。
目前已经鉴定了2个 OsCPS1的等位突变体, 即 oscps1-1和 oscps1-2, 表现严重矮化、不开花、不结实, 在突变体内未检测到内根-贝壳杉烯和有生物活性的GA1[22]。本研究报道的 s2-47株高仅为野生型的12.5%, 不能抽穗结实, 这与 oscps1-1和 oscps1-2的表型相似。突变体 oscps1-1和 oscps1-2的突变位点都位于 OsCPS1基因的第7个外显子上, 其中 oscps1-1有1个 Tos17转座子插入, oscps1-2缺失9个碱基, 而 s2-47在第6外显子上缺失1个碱基(图5-A)。如图5-B所示, OsCPS1蛋白有Terpene_synth和Terpene_synth_C两个功能结构域, 它们与萜烯合成酶活性有关。在这3个等位突变体中, 这2个功能结构域均完全缺失, 使其编码的萜烯合成酶完全失去催化活性, 不能合成具有生物活性的GA, 因此表现严重矮化及不抽穗结实的表型。
目前已报道了一些水稻赤霉素合成途径的突变体, 但表型没有像 s2-47这样严重。本实验室曾报道2个水稻 D18基因功能完全缺失突变体 s1-146a和 s2-9, 其株高大约20 cm, 比 s2-47高, 而且能够正常抽穗结实[11]。用于水稻矮化育种的矮秆资源 sd1是绿色革命基因 SD1的功能完全缺失突变体, 其株高为野生型的60%~70%, 育性和结实正常[9]。这种表型的差异可能与这3个基因在赤霉素合成途径中的位置有关。 D18基因编码的OsGA3ox2和 SD1基因编码的OsGA20ox2位于赤霉素合成途径的下游, 而 CPS编码的柯巴基焦磷酸合酶位于赤霉素合成的起始位置[22], 推测位于赤霉素合成途径上游的基因突变后引起的表型更矮化。
已有愈来愈多的实验证据表明GA生物合成受到具有生物活性GAs水平的负反馈调节。本研究中, 用外源GA3处理野生型植株, OsCPS1基因的表达量降低了; 而在突变体 s2-47中, OsCPS1的突变导致GA合成量降低, 受到低含量GA的反馈调节, OsCPS1的表达量又升高了。这些数据进一步证实了内源GA含量对GA生物合成的反馈调节。
通过EMS诱变日本晴获得1个矮秆突变体 s2-47, 其表型为极端矮化、叶色深绿、不能抽穗结实、且对赤霉素敏感。 s2-47是 OsCPS1基因1个新的等位突变体。 OsCPS1基因编码的柯巴基焦磷酸合酶是赤霉素生物合成途径中的第一个关键酶, 其表达受到体内GA含量的反馈调节。该结果为深入了解该基因的功能提供了新的遗传资源材料。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|